A revolução na resolução: como ver as moléculas da vida com criomicroscopia eletrônica
Autores
Jovens revisores
Holly, Y7 Laurus International School of Science
Resumo
Este artigo é baseado em uma entrevista com os dois autores.
A biologia estrutural é um campo voltado para a descoberta das estruturas de todos os componentes que integram os seres-vivos – desde as moléculas que existem em humanos e outros animais, passando por aquelas que estão presentes nos minúsculos micro-organismos até as que formam as plantas. Para visualizar essas estruturas, os biólogos estruturais usam técnicas de imagem sofisticadas que estão se tornando cada vez mais precisas na “observação” ou determinação da estrutura de moléculas menores e mais diversas.
A criomicroscopia eletrônica é uma técnica de imagem muito avançada e poderosa. Nela, os elétrons são enviados através de amostras congeladas a fim de determinar as estruturas de moléculas individuais, em ampliações suficientes para permitir a visualização de átomos. Essas imagens estão nos colocando um passo à frente na compreensão da estrutura e da função dos blocos básicos de construção da vida. Neste artigo, falaremos sobre os desenvolvimentos que conduziram à chamada “revolução da resolução” na microscopia eletrônica, da qual o dr. Henderson fez parte e que por fim lhe permitiu compartilhar o Prêmio Nobel de Química em 2017.
O dr. Richard Henderson ganhou o Prêmio Nobel de Química em 2017, juntamente com o prof. Jacques Dubochet e o prof. Joachim Frank, pelo desenvolvimento da microscopia crioeletrônica para determinação, em alta resolução, de biomoléculas em solução.
Quando a aparência é importante: descoberta das estruturas de moléculas biológicas
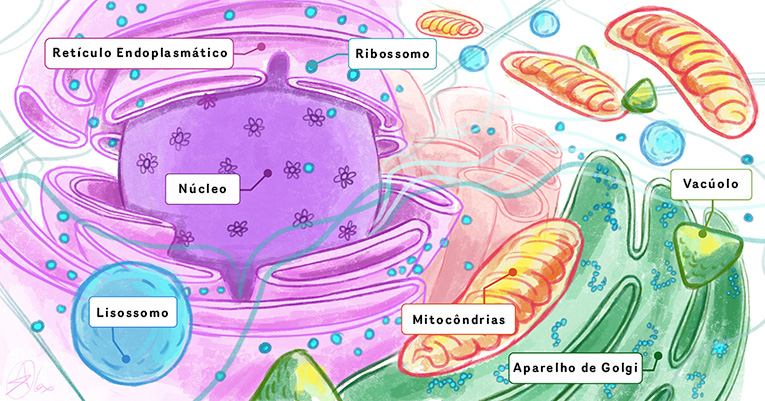
Os seres vivos contêm diversos processos e estruturas importantes. Sabemos, por exemplo, que no corpo humano existem órgãos; estes são feitos de células, e no interior delas há muitas organelas e moléculas que realizam todas as funções necessárias à manutenção da vida, que incluem produzir energia, eliminar resíduos, executar movimentos e combater fatores nocivos (Figura 1). Para entender o modo como os seres vivos funcionam, e talvez melhorar suas vidas, precisamos saber quais são as estruturas presentes em um sistema biológico e quais atividades essas estruturas desempenham. A biologia estrutural é o campo que busca observar as estruturas dos componentes biológicos.
No passado, os cientistas procuravam primeiro atividades específicas que ocorriam em um sistema biológico, como a conversão de uma fonte de energia em outra, armazenável. Encontrada a atividade, seriam identificadas as moléculas que participavam dela – geralmente proteínas e enzimas – e só então se determinariam as estruturas dessas moléculas.
No ano 2000, houve uma reviravolta na compreensão da informação genética (DNA) armazenada em nossas células. Os cientistas reuniram o primeiro “conjunto de instruções” completo (chamado sequência de bases de DNA) de informação genética humana. Desde então, em vez de procurar uma atividade, encontrar uma molécula e depois determinar sua estrutura, os biólogos estruturais podem recorrer à informação genética, que lhes fornece dados sobre todas as enzimas e proteínas do corpo. Em 2000, quando completou-se a identificação do genoma humano, cerca de 80% das moléculas codificadas em nosso DNA humano ainda não tinham sido descobertas! Isso abriu um caminho novo na biologia estrutural: agora podíamos encontrar as estruturas das moléculas sem ter que primeiro conhecer suas funções. E como encontramos as estruturas dessas moléculas? Usando pequenas partículas chamadas elétrons!
Elétrons e microscopia eletrônica
Os elétrons são pequenas partículas, eletricamente carregadas, presentes em todos os átomos. O movimento dos elétrons é que cria a eletricidade, sendo os elétrons também a fonte da luz e outras formas de radiação eletromagnética, tais como os raios X. Você acredita que, até 1895, ninguém sabia que os elétrons existiam? Naquele ano, eles foram identificados e nomeados por J. J. Thompson, um cientista do departamento de física da Universidade de Cambridge, no Reino Unido. Trinta anos depois, em 1935, G. P. Thompson (filho de J. J. Thompson) mostrou que os elétrons se comportavam tanto como partículas quanto como ondas – eles têm uma frequência e um comprimento de onda, exatamente como as outras ondas. J. J. e G. P. Thompson receberam ambos o Prêmio Nobel: pela descoberta do elétron como partícula e pela descoberta do elétron como onda.
Pouco tempo depois, os cientistas perceberam que, se os elétrons se comportam como onda, em certo sentido devem se comportar como luz – porque a luz também se comporta como onda. Então, concluíram que talvez pudessem usar elétrons para iluminar amostras minúsculas que desejassem observar, assim como podemos olhar para um objeto com nossos olhos, com uma câmera ou um microscópio comum – mas usando elétrons em vez de luz visível. Tal foi o início da microscopia eletrônica, uma técnica de imagem muito poderosa.
Os elétrons têm um comprimento de onda muito reduzido, cerca de 100.000 vezes menor que o comprimento de onda da luz. Você pode pensar no comprimento de onda da luz como um parâmetro para dar um “zoom” – quanto menor o comprimento de onda, mais podemos “aumentar o zoom” em nosso espécime. Isso significa que as fotos tiradas com elétrons têm um nível muito alto de detalhes, o que é chamado de alta resolução. Devido a essa alta resolução, o microscópio eletrônico pode ser usado para descobrir as estruturas de moléculas minúsculas de um modo que não era possível anteriormente.
Como funciona um microscópio eletrônico?
Na microscopia eletrônica, um feixe energético de elétrons emerge de uma fonte de elétrons e passa pela amostra em estudo (Figura 2A). Quando os elétrons passam pela amostra, interagem com seus átomos e são difratados, ou desviados do curso, de acordo com o arranjo de átomos que encontram. Desse modo, ao passar pelo material, os elétrons “captam” sua estrutura. Depois de difratados, os elétrons são coletados e focados mediante o uso de lentes (muito parecidas com as de uma câmera) e finalmente são registrados por um detector de elétrons. Nessa fase, os cientistas obtêm uma imagem dos elétrons que foram difratados da amostra e podem convertê-la em uma imagem da própria amostra.
Essa conversão é baseada em uma física simples, que descreve a relação entre um objeto medido e a imagem resultante. A conversão depende de muitos fatores, incluindo o comprimento de onda dos elétrons e as lentes usadas; mas nada disso é problema para os especialistas em microscopia.

Desafios da microscopia eletrônica
Embora os elétrons possam nos ajudar a obter imagens notáveis de moléculas, usá-los para visualizar moléculas biológicas implica grandes desafios. Primeiro, os elétrons individuais não são “lógicos” – quando você lhes faz uma pergunta (por exemplo, o que acontece quando encontram uma determinada molécula), eles não dão uma resposta definitiva como um humano daria. Em vez disso, têm uma certa probabilidade de participar de cada resultado possível. No mundo do elétron, tudo o que possa acontecer acontece, com uma certa probabilidade para cada opção. Isso significa que os cientistas precisam coletar muitas respostas de muitos elétrons e combinar inteligentemente as informações a fim de obter a resposta geral. Para isso, iluminam a amostra com milhões de elétrons e usam a média geral de suas propriedades para obter uma resposta aceitável.
Em segundo lugar, os elétrons às vezes danificam a amostra, pois têm muita energia e devem passar por todo o material até chegarem ao detector. Suas temperaturas podem chegar a cerca de dois bilhões de °C (por comparação, a água ferve a 100°C!). Esses elétrons superenergizados e qualquer outro tipo de radiação semelhante podem arrancar os elétrons das moléculas da amostra. Isso altera as formas e propriedades das moléculas da amostra porque moléculas biológicas são relativamente delicadas. Assim, é difícil para os cientistas obterem informações suficientes sobre a estrutura de uma molécula biológica simples antes que ela seja destruída.
Uma maneira de enfrentar esse desafio é obter imagens de muitas moléculas idênticas e separadas – pelo menos quinhentas, no caso da microscopia eletrônica de moléculas biológicas – e fazer a média das imagens para obter a estrutura de uma molécula típica. Outra maneira de enfrentar esse desafio é resfriar a amostra de um modo especial, que a torna mais resistente a danos nos elétrons (falaremos disso na próxima seção).
Outro desafio está no fato de que os elétrons são difratados assim que se aproximam de quaisquer átomos. Isso significa que deve haver um caminho totalmente livre entre a fonte de elétrons e a amostra para que os elétrons cheguem às moléculas desejadas e não se dispersem devido a outras moléculas, até mesmo do oxigênio e do nitrogênio no ar, que estão no caminho. Em outras palavras, os cientistas devem criar um vácuo ao redor da amostra no microscópio eletrônico. Como as moléculas biológicas estão sempre em solução aquosa (pense, por exemplo, nas moléculas de seu sangue), o problema é que a água se evapora no vácuo e a amostra seca. Essa secagem, muitas vezes, danifica as moléculas biológicas na amostra. Superar esse desafio exigiu que os biólogos estruturais usassem sua criatividade para aproveitar as propriedades exclusivas da água.
A água pode se manter líquida quando está muito fria?
Eis aqui um experimento muito legal que você pode fazer em casa para entender uma das propriedades exclusivas da água (Figura 3). Pegue uma jarra vazia com tampa e encha-a de água. Feche hermeticamente a tampa para não permaneçam bolhas de ar na jarra e coloque-a no freezer. Deixe-a ali por um dia – a temperatura da água cairá para — -10°C ou -20°C (a água normalmente se torna gelo a 0°C). No dia seguinte, tire a jarra do freezer e dê uma olhada – a água se transformou em gelo sólido ou continua líquida?
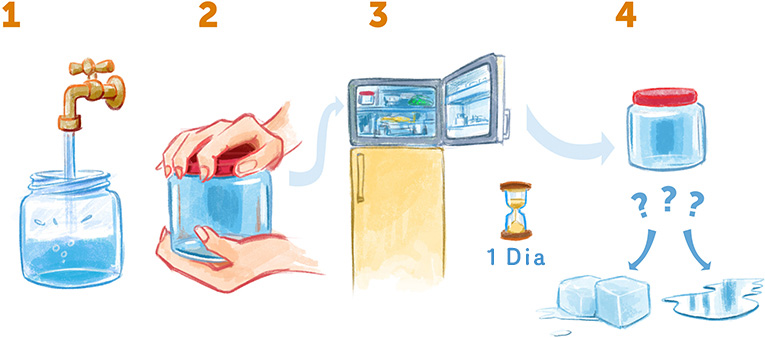
Na maioria das vezes, você descobrirá que a água ainda está líquida – ela foi super-resfriada, isto é, se resfriou a uma temperatura inferior à de congelamento (0°C), mas sem se transformar em gelo. Em nossos experimentos, queremos resfriar a água ainda mais, abaixo de -170°C, porque a essa temperatura ela fica imóvel e muito estável. Também queremos evitar a formação de cristais de gelo, pois eles interferem em nossas medições. Para conseguir isso, devemos usar um método especial de resfriamento desenvolvido no laboratório de Jacques Dubochet, que dividiu o prêmio Nobel de Química comigo, Richard Henderson, e Joachim Frank em 2017.
Nesse método, utilizamos etano e propano líquidos muito frios (substâncias encontradas no gás natural, formadas a partir de carbono e hidrogênio), resfriados a -185ºC. Em seguida, mergulhamos uma película muito fina de água no etano/propano líquido resfriado, que esfria tão rapidamente – em cerca de 1/1.000 de segundo – que não tem tempo para formar cristais de gelo organizados e permanece no estado de líquido desorganizado [1] que chamamos de gelo amorfo. Assim, obtemos a água super-resfriada.
A fórmula mágica de elétrons quentes e amostras frias
Acontece que películas finas super-resfriadas de água são ótimas para suspender as moléculas biológicas que queremos visualizar com microscópios eletrônicos. Quando adicionamos essa etapa de resfriamento ao processo de imagem, temos a chamada criomicroscopia eletrônica (“crio” é a abreviação de “criogênico”, termo que se refere ao resfriamento).
A criomicroscopia eletrônica nos permite enfrentar os dois desafios mencionados acima: ela estabiliza a amostra, tornando-a mais resistente a danos causados por elétrons, o que permite às moléculas biológicas permanecerem em seu ambiente aquático natural, sem a evaporação da água devido ao vácuo. Há mais uma vantagem importante: ao contrário da maioria dos outros líquidos, a água se expande quando resfriada abaixo de 4°C. Essa característica da água ajuda as moléculas biológicas a permanecerem intactas quando estão em água super-resfriada. Caso se contraísse quando resfriada, a água comprimiria as moléculas e, possivelmente, as fragmentaria.
Esse método de imagem de criomicroscopia eletrônica bastante simples, mas altamente eficaz, nos permite visualizar moléculas biológicas em uma resolução que antes era inatingível. É por isso que às vezes ela é chamada de “revolução da resolução”.
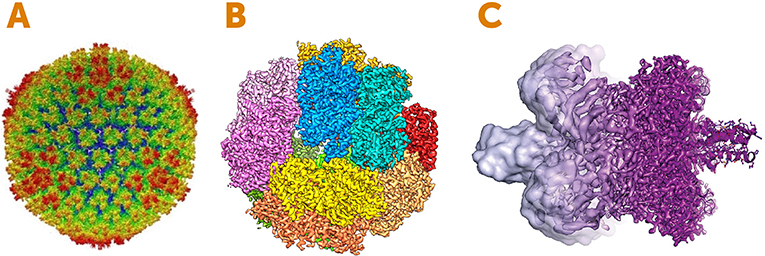
A Figura 4 mostra exemplos de imagens bonitas obtidas usando-se o microscópio eletrônico. Estamos falando de escalas verdadeiramente minúsculas – décimos de nanômetros, que são menores do que 1/1000 da largura de um fio de cabelo humano! Esperamos que você esteja começando a apreciar a maravilha da criomicroscopia eletrônica!
Qual será o futuro para a criomicroscopia eletrônica?
Os elétrons são as melhores partículas para se usar na geração de imagens de pequenas moléculas biológicas. Para você ter uma ideia de como eles são bons, vamos compará-los a duas partículas comumente usadas: fótons de raios X (semelhantes às partículas de luz, mas com comprimentos de ondas curtos) e nêutrons (partículas dos núcleos dos átomos). Quando comparamos a quantidade de informação que recebemos ao usar uma determinada partícula com o dano que ela provoca na amostra, descobrimos até que ponto essa partícula é boa para a geração de imagens. Usando-se esse cálculo, os elétrons são mil vezes melhores que os raios X e três vezes melhores do que os nêutrons! Por isso meus colegas e eu começamos a usar elétrons em vez de outras partículas. A criomicroscopia eletrônica foi tão bem-sucedida que o número de biólogos estruturais que a utilizam é muito grande e cresce rápido.
Há, ainda, melhoramentos significativos a serem feitos na microscopia eletrônica. Um deles consiste em aperfeiçoar os detectores de elétrons, que ainda não são suficientemente grandes ou eficientes e requerem o uso de muito mais elétrons do que o exigido teoricamente. Também seria útil minimizar o movimento da amostra (tanto as moléculas de água quanto as biológicas) quando ela entra em contato com o feixe de elétrons [4,5]. Acreditamos que, em cerca de cinco anos, haverá avanços significativos para enfrentarmos esses desafios. Teremos então uma ferramenta ainda mais poderosa que nos permitirá compreender melhor muitas questões biológicas, como o funcionamento da vida e sua reprodução. As informações que adquirimos ajudam a preservar a saúde das pessoas, animais e plantas. Podemos esperar um futuro muito brilhante para a criomicroscopia eletrônica!
Recomendações para as mentes jovens
Eu, Richard, quero compartilhar alguns conselhos práticos que tenho seguido ao longo de minha carreira e provêm dos escritos de Peter Medawar, ganhador do Prêmio Nobel de Fisiologia ou Medicina em 1960. Depois de ganhar esse prêmio, Peter Medawar publicou dois livros intitulados The Art of the Soluble [A arte do solúvel] e Advice to a Young Scientist [Conselho a um jovem cientista].
Nesses livros, ele afirmou que há muitas coisas atraentes na ciência e na vida, e que deveríamos nos interessar por tudo. Mas deveríamos também escolher algo específico, que gostaríamos de aprofundar. Além disso, sugeriu que os cientistas deveriam trabalhar em algo que produzisse novos conhecimentos logo – não em cem anos, porque isso está além do tempo de vida de um cientista. Sua ideia era que a ciência é a arte do solúvel, ou seja, problemas que podem ser solucionados. Os cientistas deveriam fazer experimentos com aquilo que funciona agora, empregando as técnicas atualmente disponíveis.
Quando eu era um jovem estudante, me perguntava para seria o futuro da física e fiz uma lista de todos os tópicos interessantes por vir. Havia a pesquisa de fusão, sobre a produção de energia ilimitada a partir da fusão do hidrogênio. Havia também a física de partículas de alta energia, que levou à descoberta de novas partículas, incluindo o bóson de Higgs e outras. Tínhamos a física do estado sólido, importante para o desenvolvimento da indústria dos computadores e microchips. Biofísica, astrofísica, cosmologia, buracos negros e estrelas de nêutrons eram outros temas interessantes, para citar apenas alguns (Figura 5). Se você escolhesse alguns desses tópicos para estudar, eles seriam igualmente interessantes e excitantes. Assim, se decidir praticar ciência, deve escolher alguma área em que esteja interessado, para estudá-la e praticá-la sem que ninguém o force a isso.
Quando você está interessado e motivado, se encontrar dificuldades, elas não o incomodarão muito – você apenas as aceitará como um desafio e seguirá em frente. Uma vez escolhido um tópico interessante, antes de realmente seguir nessa direção, será conveniente aprender o máximo possível sobre as várias atividades que poderá empreender para se aprofundar no assunto. Se, após seis meses ou um ano dando o melhor de si, reconhecer que sua ideia não é tão boa, não hesite em refletir novamente e enveredar por um novo caminho.

Hoje, a ciência está caminhando muito mais rapidamente que no passado. Há apenas cem anos, nem sabíamos da existência dos raios X e dos elétrons, mas agora temos informações sobre todo o genoma humano, dispomos de métodos sofisticados para trabalhar com o DNA e podemos conhecer a estrutura de praticamente qualquer coisa que desejarmos. Os próximos cem anos serão um momento muito bom para se viver – e ser cientista. Aproveite a sua vida e invista no que for mais interessante para você!
Glossário
Biologia estrutural: Campo da biologia que estuda as estruturas dos componentes dos seres-vivos.
Proteína: Pequena máquina biológica que desempenha muitas funções essenciais no corpo.
Enzima: Molécula biológica que acelera as reações químicas no corpo.
Informação genética (DNA): Informação, transmitida de pais para filhos, que determina as características e o comportamento de um organismo.
Frequência: Número de vezes que uma onda se repete em um segundo.
Comprimento de onda: Distância ao longo da qual a forma de uma onda se repete.
Microscopia eletrônica: Técnica que usa elétrons para criar imagens de pequenas estruturas, incluindo moléculas biológicas.
Difração: Dispersão de uma onda por um objeto; por exemplo, a dispersão de elétrons por um espécime.
Super-resfriado: Resfriado abaixo da temperatura de congelamento, mas ainda líquido (ou seja, sem cristalização).
Criomicroscopia eletrônica: Técnica que usa elétrons para criar imagens de moléculas biológicas mantidas em água e resfriadas a temperaturas baixas muito rapidamente.
Conflito de interesses
Os autores declaram que a pesquisa foi realizada sem nenhuma relação financeira ou comercial capaz de gerar conflito de interesses.
Agradecimentos
Agradecemos a Alex Bernstein por fornecer as imagens e a Susan Debad por editar o manuscrito.
Referências
[1] Dubochet, J., Lepault, J., Freeman, R., Berriman, J. A. e Homo, J.-C. 1982. “Electron microscopy of frozen water and aqueous solutions.” J. Microscopy 128.219–37. DOI: 10.1111/j.1365-2818.1982.tb04625.x.
[2] Liu, H., Jin, L., Koh, S. B. S., Atanasov, I., Schein, S., Wu, L. et al. 2010. “Atomic structure of human adenovirus by cryo-EM reveals interactions among protein networks.” Science 329:1038–43. DOI: 10.1126/science.1187433.
[3] Allegretti, M., Mills, D. J., McMullan, G., Kühlbrandt, W. e Vonck, J. 2014. “Atomic model of the F420-reducing [NiFe] hydrogenase by electron cryo-microscopy using a direct electron detector.” Elife 3:e01963. DOI: 10.7554/eLife.01963.
[4] Vinothkumar, K. R. e Henderson, R. 2016. “Single particle electron cryomicroscopy: trends, issues and future perspective.” Q. Rev. Biophys. 49:e13. DOI: 10.1017/S0033583516000068.
[5] Henderson, R. 2015. “Overview and future of single particle electron cryomicroscopy.” Arch. Biochem. Biophys. 581:19–24. DOI: 10.1016/j.abb.2015.02.036.
Citação
Segev, N. e Henderson, R. (2023). “Resolution revolution – seeing the molecules of life with electron cryomicroscopy.” Front. Young Minds. 11:1063909. DOI: 10.3389/frym.2023.1063909.
Este é um artigo de acesso aberto distribuído sob os termos da Creative Commons Attribution License (CC BY). O uso, distribuição ou reprodução em outros fóruns é permitido, desde que o(s) autor(es) original(is) e o(s) proprietário(s) dos direitos autorais sejam creditados e que a publicação original nesta revista seja citada, de acordo com a prática acadêmica aceita. Não é permitido nenhum uso, distribuição ou reprodução que não esteja em conformidade com estes termos.
Encontrou alguma informação errada neste texto?
Entre em contato conosco pelo e-mail:
parajovens@unesp.br