O ribossomo: a fábrica que produz proteínas de acordo com o código genético
Autores
Ada Yonath, Elinor Breiner Goldshtein, Noa Segev
Jovens revisores

Resumo
As proteínas são pequenas máquinas biológicas que atuam em nossos corpos, e em todos os animais, plantas, vírus e bactérias. Elas são responsáveis por uma ampla gama de atividades vitais. As proteínas são sintetizadas segundo as instruções contidas no código genético, dentro de seu DNA, por uma organela celular chamada ribossomo. O ribossomo reúne proteínas com muita rapidez e precisão. A maior parte de minha pesquisa é dedicada à compreensão da função do ribossomo com base na sua estrutura, tal como nós a determinamos. Neste artigo, descrevo as principais descobertas de minha pesquisa, algumas aplicações importantes dessas descobertas e os desafios que enfrentei ao longo do caminho.
A professora Ada Yonath recebeu o Prêmio Nobel de Química em 2009, juntamente com o professor Venkatraman Ramakrishnan e o professor Thomas A. Steitz, por estudos sobre a estrutura e a função do ribossomo.
Do DNA às proteínas
Cada célula viva contém um código genético, que são as instruções para a criação dos componentes de uma célula, e da totalidade do organismo vivo. Essa substância é transmitida dos pais para os filhos. O material genético chama-se DNA e pode ser considerado um livro de receitas que contém todas as informações necessárias para a criação e funcionamento do organismo vivo.
Um dos componentes mais importantes do DNA são os genes, que contêm instruções para a síntese de proteínas – o “maquinário” das células e de todo corpo vivo. As proteínas desempenham muitas ações que são importantes para o funcionamento do corpo. Todas as proteínas naturais consistem de uma combinação de cerca de 20 blocos de construção chamados aminoácidos. Para formar uma proteína, os aminoácidos são unidos como contas em um rosário. Essa conexão é chamada de ligação peptídica, e uma proteína de tamanho médio contém entre 150 e 500 aminoácidos ligados entre si. Cada uma dessas cadeias longas de aminoácidos se dobra em uma estrutura tridimensional funcional única, determinada pela sequência de aminoácidos que as compõe. A estrutura da proteína é adaptada com precisão para que a proteína execute seu trabalho (Figura 1).
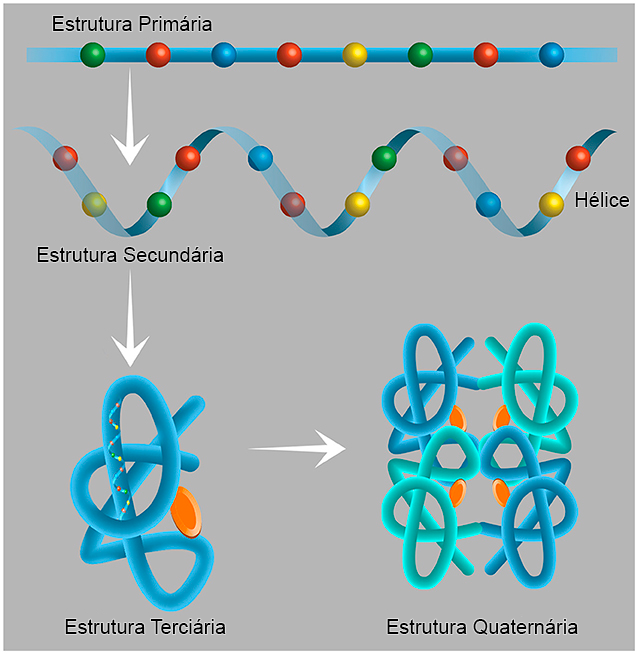
Cada uma das cadeias proteicas se dobra de acordo com as propriedades de seus componentes para formar a estrutura secundária, que pode assumir diversas formas, inclusive a de uma hélice. A estrutura terciária é a estrutura tridimensional da proteína, ou seja, o arranjo das hélices e das cadeias conectando as hélices que permite a execução das funções específicas dessa proteína. Algumas proteínas são ativas na forma de aglomerados – o arranjo das proteínas em um aglomerado é chamado de estrutura quaternária. Esses aglomerados consistem em pelo menos dois componentes proteicos unidos de uma forma que permite sua atividade. (Adaptação de uma figura original visível aqui.)
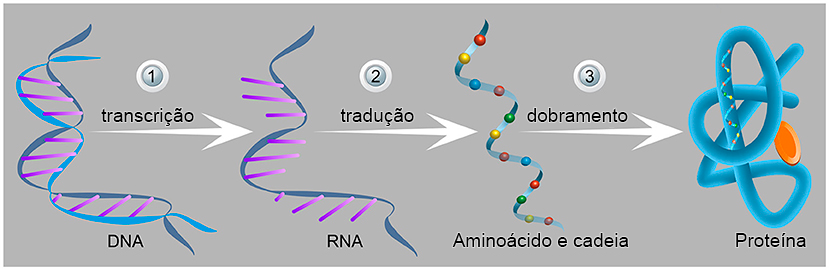
A produção de proteína nas células ocorre em várias etapas (Figura 2). Na primeira, uma parte do DNA que contém o material genético é copiado no RNA mensageiro (RNAm) em um processo chamado transcrição. Uma molécula de RNAm é uma “cópia” da informação genética que permite ao material genético ser transferido para dentro da célula sem “colocar em risco” o código original.
Na etapa seguinte, o RNAm chega ao ribossomo, a “fábrica” da célula para a produção de proteínas. O ribossomo “lê” as instruções do RNAm e prepara a proteína desejada formando uma cadeia de aminoácidos unidos entre si por ligações peptídicas. Depois de sair do ribossomo, as cadeias de proteínas são dobradas na estrutura tridimensional adequada e necessária para o funcionamento da proteína. Esse processo de produção de proteínas no ribossomo é chamado de tradução. O resto deste artigo mostrará como o processo de tradução ocorre no ribossomo.
O ribossomo
A tradução de uma nova proteína é um processo complicado. A “receita” das proteínas está codificada no código genético (DNA e RNAm), em uma “linguagem” genética de quatro letras que é traduzida em uma “linguagem” de aminoácidos onde há cerca de 20 blocos de construção diferentes – os aminoácidos. Você, provavelmente, está se perguntando: “Como isso é possível?”. O processo é chamado tradução, um nome que já se explica. A solução para esse problema é que o ribossomo lê o código genético como uma série de combinações de três letras de nucleotídeos chamadas códons. Cada códon corresponde a um aminoácido específico (alguns aminoácidos têm mais de um códon, que corresponde a um aminoácido específico. Às vezes, há até quatro códons diferentes que são traduzidos no mesmo aminoácido) ou a um sinal de parada.
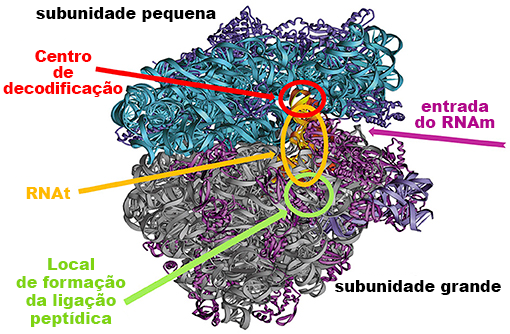
O ribossomo é responsável pela tradução, ou seja, cria as conexões entre os aminoácidos na proteína nascente. O ribossomo é uma organela celular composta por duas subunidades: a subunidade ribossômica pequena e a subunidade ribossômica grande (Figura 3), cada qual com uma função específica.
A unidade ribossômica pequena é responsável pela leitura do código genético do RNAm e pela correspondência entre o códon RNAm ligado e o anticódon correspondente no RNA de transferência (RNAt). O local onde o código genético é lido é chamado de centro de decodificação. A subunidade ribossômica grande é responsável por catalisar a nova ligação peptídica entre os aminoácidos e por passar a proteína sintetizada ao longo do ribossomo para o Túnel de Saída do Peptídeo Nascente (TSPN).
No centro catalítico do ribossomo, o centro da peptidiltransferase (CPT), os aminoácidos se ligam entre si e uma nova ligação peptídica é formada. O CPT permite a ligação dos dois aminoácidos, pois ali dentro eles estão situados próximos um do outro e na orientação adequada para criar uma nova ligação peptídica. Depois que a nova ligação aparece, o RNAt que sustenta a proteína nascente vai junto com o RNAm para a “próxima estação” ao longo do ribossomo, ficando tudo pronto para a formação de uma nova ligação peptídica. A cadeia proteica nascente passa pela subunidade ribossômica grande do TSPN e emerge na outra extremidade do ribossomo.
As subunidades ribossômicas pequena e grande se ligam umas às outras durante a montagem da proteína e se separam quando a tradução da proteína é concluída. Cada subunidade consiste de proteínas e cadeias de RNA muito longas chamadas RNA ribossômico (RNAr) (Figura 3) [1].
Há muitos ribossomos em cada célula viva – de dezenas de milhares em bactérias, por exemplo, a milhões em células humanas. O trabalho dos ribossomos exige muita energia – mais de 60% do total de energia utilizada pela célula [2]! Isso destaca a importância do ribossomo dentro da célula, pois ele é a fábrica que produz as proteínas necessárias para todas as atividades celulares. O ribossomo funciona a uma velocidade incrível: um ribossomo bacteriano pode produzir uma proteína de tamanho médio levando de alguns segundos a um minuto.
A tradução do ribossomo de uma molécula de RNAm ocorre em três etapas: início, alongamento e término. Durante o início, o RNAm se liga à subunidade ribossômica pequena do ribossomo. Em seguida, um RNAt carregando o aminoácido metionina se liga ao códon inicial da sequência de RNAm. O códon inicial em todas as moléculas de RNAm possui a sequência AUG, que codifica a metionina. Os fatores de iniciação unem-se à subunidade ribossômica pequena, ao RNAm e ao RNAt, formando-se assim o complexo de início. Depois, a subunidade ribossômica grande se liga e forma o complexo de tradução, ou seja, o ribossomo ativo.
Durante a etapa de alongamento, o ribossomo traduz cada códon por vez. Para cada aminoácido, existe um RNAt separado e único que se liga ao ribossomo e carrega consigo o aminoácido. À medida que o ribossomo se move ao longo do RNAm, novas moléculas de RNAt carregadas com o aminoácido correspondente continuam se ligando e se movendo entre os três sítios ou locais ativos do ribossomo: o sítio aminoacil (local A), o sítio peptidil (local P) e o sítio de saída (local S) (Figura 4). Em seguida, o próximo RNAt carrega um aminoácido, entra no ribossomo, liga-se ao local A, uma ligação peptídica é formada entre os aminoácidos ligados ao local A e ao local P, e a cadeia proteica nascente avança para dentro do TSPN. Mais tarde, o RNAt do local P se move para o local S e é liberado do ribossomo.
O RNAt do local A se move para o local P e um novo RNAt se liga ao local A. Cada vez que um novo aminoácido chega, ele se prende ao aminoácido anterior por uma ligação peptídica. Dessa forma, a cadeia proteica nascente é formada [3]. A cadeia peptídica em crescimento atravessa o ribossomo por um túnel de saída do peptídeo nascente (TSPN) e sai do ribossomo. O alongamento continua enquanto o RNAm avança pelo ribossomo e apresenta novos códons. O término ocorre quando o ribossomo atinge um códon de parada. Um códon de parada é um códon no RNAm que nenhuma molécula de RNAt consegue reconhecer. Quando a tradução é concluída, as duas subunidades do ribossomo são separadas e a proteína nascente sai e se dobra em sua estrutura tridimensional, sozinha ou com ajudantes (acompanhantes).
Dessa forma, a nova proteína é liberada do ribossomo e pode desempenhar sua função na célula (um vídeo que descreve esse processo pode ser encontrado aqui).
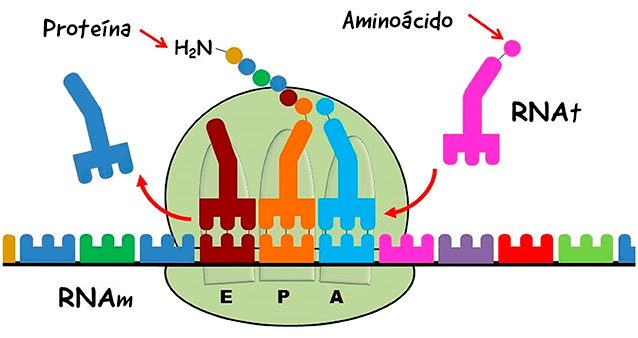
A subunidade ribossômica pequena decodifica o RNAm (cadeia multicolorida) que contém as instruções para a montagem da proteína. A subunidade ribossômica grande catalisa a formação de ligações peptídicas e sintetiza a cadeia proteica nascente de acordo com as instruções do RNAm da seguinte forma: o primeiro RNA de transferência (RNAt) carregado com o aminoácido correspondente (círculo colorido) liga-se ao local peptidil (local P), em seguida o próximo RNAt carregado se liga ao local aminoacil (local A) do ribossomo.
Uma nova ligação peptídica é formada entre os aminoácidos ligados ao RNAt no local peptidil (local P) e no local A (círculos azul-claro e laranja nos locais A e P). O RNAt do local P é transferido para o local de saída (local S) (vermelho-escuro), o RNAt do local A é transferido para o local P com a cadeia proteica nascente ligada a ele e um novo RNAt carregado com o próximo aminoácido pode se ligar ao local A.
Ao final do processo, a cadeia de aminoácidos é liberada do ribossomo e dobrada para assumir a forma da proteína funcional. (Crédito da imagem: figura do Google modificada por Ada Yonath.)
Como nós descobrimos a estrutura do ribossomo? Desenvolvemos um método exclusivo para fazer isso, que discutiremos na próxima seção.
Cristalografia inspirada em ursos polares
Conseguimos decifrar a estrutura e a função do ribossomo usando um método chamado cristalografia, que nos permite estudar materiais cristalizados.
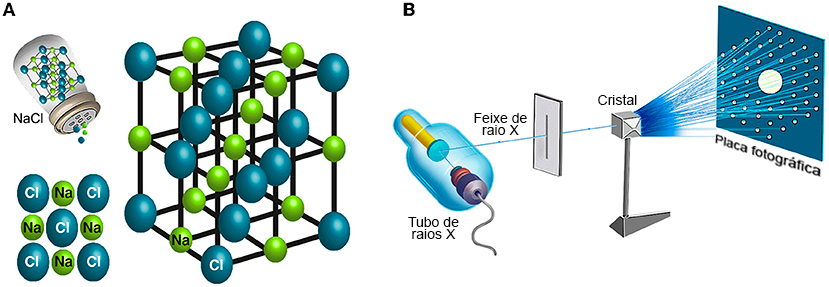
Um cristal é uma estrutura composta por unidades com simetria interna que se repetem no espaço de forma ordenada. A unidade de repetição mais simples e menor em um cristal é chamada de “célula unitária”. Uma célula unitária de sal de cozinha é mostrada na Figura 5A. Cada célula unitária em um cristal tem uma medida fixa de comprimento, altura, largura e ângulos fixos entre suas superfícies. Em um cristal, as células unitárias são dispostas periodicamente em três dimensões, lado a lado, como ladrilhos. Na cristalografia, o cristal é irradiado com um feixe de raios X uniforme e muito concentrado (Figura 5B).
Os átomos presentes em cada célula unitária do cristal difratam o feixe de raios X em algumas direções específicas, determinadas pela lei física chamada lei de Bragg, bem como suas propriedades e posições, quando o feixe de raios X os atinge. Durante a irradiação, imagens da dispersão do feixe são capturadas e coletadas em uma tela (Figura 5B, tela à direita) ou detector. Usando esses padrões de difração por meio de procedimentos matemáticos chamados equações de Fourier, podemos decifrar a estrutura tridimensional da célula unitária.
O primeiro requisito para decifrar a estrutura por meio de raios X é a preparação dos cristais. Alguns materiais, como açúcar, sal de cozinha e pedra de quartzo, são cristais naturais – eles são estáveis e sólidos. Mas a maioria dos materiais e estruturas da natureza e do corpo, como as proteínas (por exemplo, a hemoglobina) ou seus complexos, como os ribossomos, não é cristalizada naturalmente. Portanto, o primeiro desafio da nossa pesquisa foi encontrar condições para cristalizar os ribossomos, que são complexos, flexíveis e com multicomponentes – tarefa antes considerada impossível, uma vez que vários cientistas famosos já haviam tentado e falhado.
Durante muito tempo, não conseguimos cristalizar os ribossomos devido à sua estrutura extremamente complicada. Em virtude de suas exigências funcionais no corpo, eles possuem habilidades motoras – e tendem a se desagregar fora da célula, dificultando ainda mais sua cristalização.
Uma das muitas descobertas importantes que fizemos ao tentar cristalizar o ribossomo foi inspirada nos ursos polares. Descobriu-se que, durante a hibernação, parte dos ribossomos dos ursos é mantida em uma estrutura densa, quase periódica, ao longo de todo o inverno, até que os ursos acordem na primavera. Presumimos que isso acontecia para que os ribossomos dos ursos não se desfizessem quando ficavam inativos durante o inverno – e voltassem a funcionar na primavera. Isso nos revelou que, sob estresse ou condições extremas, os ribossomos tendem a se organizar em uma densidade quase periódica e, por isso, resolvemos produzir cristais a partir de ribossomos de bactérias que vivem sob condições extremas de estresse no Mar Morto. Assim, graças a um trabalho intenso e depois de tentar inúmeras condições diferentes, conseguimos obter cristais estáveis de ribossomos ativos.
Após a produção dos cristais, sabíamos que enfrentaríamos outra dificuldade. O feixe de raios X que tivemos que usar para decifrar a estrutura do ribossomo era de altíssima energia (produzido em aceleradores gigantes, por exemplo, de Grenoble, Stanford ou APS), que afeta as ligações químicas entre os átomos dos cristais do ribossomo e causa a migração de átomos. Isso significa que, à medida que irradiamos o cristal para recolher dados sobre sua estrutura, nós o destruímos. Na prática, portanto, não seríamos capazes de medir mais do que uma baixa porcentagem das informações exigidas para determinar a estrutura do ribossomo.
Sabíamos que tínhamos de encontrar um modo para coletar dados suficientes do ribossomo cristalizado antes que ele fosse destruído. Por isso, tentamos fabricar cristais que durassem mais para podermos fazer mais medições.
Desenvolvemos um método para reduzir os danos causados pela radiação de raios X, congelando rapidamente os cristais a temperaturas muito baixas (em torno de -200 graus Celsius, usando nitrogênio líquido), sob condições que impediriam a formação de cristais de gelo no líquido circundante do ribossomo cristalizado, visando a minimizar a capacidade dos átomos dos ribossomos de se movimentarem após suas ligações serem quebradas pelo feixe intenso. Utilizando misturas de solventes especiais, aperfeiçoamos um procedimento que nos permitiu minimizar a propagação dos danos causados pela radiação. Ou seja, medindo a difração de pequenas áreas de cristais resfriados, minimizando os danos durante as medições e evitando a propagação dos átomos quebrados para todas as áreas do cristal que ainda não haviam sido expostas à radiação.
Usando esse método e alguns outros procedimentos experimentais desenvolvidos anos antes no Instituto Weizmann de Ciência, conseguimos manter a capacidade de difração dos cristais do ribossomo por um longo tempo e, por fim – após 20 anos –, também decifrar sua estrutura e compreender como ela funciona.
Ao longo de todo o nosso projeto, muitos cientistas pensavam que era impossível decifrar a estrutura do ribossomo. Cientistas renomados até zombaram de nós por causa do enorme desafio que estávamos tentando vencer. Mas, graças à nossa determinação e criatividade, conseguimos cumprir a missão, procurando constantemente soluções “fora da caixa”. Na verdade, apesar da desconfiança quanto à nossa capacidade no mundo científico e do grande desprezo pelo nosso método de resfriamento profundo, toda a biocristalografia o adotou em poucos meses. Nosso notável sucesso também levou a uma importante aplicação médica, sobre a qual você lerá na próxima seção.
Lutando pela saúde – como neutralizar bactérias
Conforme mencionamos anteriormente, o ribossomo é um componente muito importante de cada célula viva. Quando a função do ribossomo é significativamente prejudicada, a célula para de produzir proteínas e não consegue continuar a funcionar. Isso também é verdade para as bactérias. Os ribossomos bacterianos funcionam de forma semelhante aos ribossomos humanos, mas suas estruturas são ligeiramente diferentes, embora de forma significativa, das estruturas dos ribossomos humanos. Essas diferenças nos permitem usar antibióticos que atacam as bactérias sem ferir os pacientes.
Há várias famílias de antibióticos. Os antibióticos naturais são produzidos por bactérias como armas nas “guerras” entre diferentes tipos de bactérias que lutam pelos mesmos recursos. Eles danificam outras bactérias paralisando mecanismos essenciais para a atividade bacteriana. Um desses alvos é o ribossomo.
Embora o ribossomo seja enorme comparado com o tamanho do antibiótico, a maioria dos antibióticos ata e bloqueia os locais ribossômicos ativos: por exemplo, eles inativam o CPT ou bloqueiam o TSPN na subunidade ribossômica grande, evitando assim o crescimento da cadeia proteica (Figura 4) e interrompendo seu alongamento. Outro alvo no ribossoma é bloquear o movimento do RNAm dentro da subunidade ribossômica pequena. Esse bloqueio impede que o RNAm seja lido corretamente, e isso é necessário para a produção de uma proteína adequada. Outros antibióticos têm como alvo o local A da subunidade ribossômica pequena e evitam que o RNAt se ligue ao ribossomo. Quando isso acontece, o aminoácido não pode se ligar ao próximo aminoácido na cadeia [4]. Clique aqui para ver um vídeo que demonstra como os antibióticos podem perturbar a função dos ribossomos bacterianos.
Na verdade, os resultados de nossa pesquisa têm aplicações importantes no campo da medicina. Mas você pode ter ouvido que algumas doenças causadas pelas bactérias desenvolvem resistência a certos antibióticos, o que as torna até mais perigosas. A compreensão da estrutura e função do ribossomo permitiu-nos entender melhor como funcionam os diferentes antibióticos e como as bactérias desenvolveram mecanismos de resistência a eles, fornecendo assim ideias sobre como combater a resistência aos antibióticos. Esse é um exemplo de como a enorme perseverança e a luta que investimos ao longo de dezenas de anos na decifração da estrutura e da função do ribossomo foram justificadas e deram frutos. Eu gostaria aqui de compartilhar com você algumas recomendações que formulei como resultado desse processo.
Recomendação para mentes jovens
Minha principal recomendação é: siga sua curiosidade. Se você tentar contribuir com novas informações científicas para um campo científico que o entusiasme muito, poderá enfrentar problemas na busca de apoio – especialmente no início. Algumas pessoas dirão que você não tem nenhuma chance de sucesso. Outras insinuarão que sua pesquisa é enganosa e até um desperdício do dinheiro público.
Recomendo que se concentre em sua curiosidade – seja forte e autoconfiante, mesmo que ainda não tenha alcançado seu objetivo. Se você se aprofundar no problema que lhe interessa e em sua base lógica, aumentará as chances de solução. Meu objetivo era decifrar a estrutura do ribossomo. Ao longo do processo, acreditei que, mesmo se não conseguisse decifrar toda a estrutura, faria progressos científicos significativos ao longo do caminho. Já antes de a estrutura do ribossomo ser decifrada, minha pesquisa facilitou o desenvolvimento de novos métodos em cristalografia. Esses métodos levaram à solução de dezenas de milhares de estruturas até então desconhecidas, solução que ajudou a melhorar a nossa compreensão de muitos processos biológicos.
Outro aspecto que eu gostaria de compartilhar com você é que, quanto mais desafiador for o caminho, maior será a satisfação ao final. Portanto, seja determinado e trabalhe para superar as dificuldades que surgirem no seu caminho, confiando em que uma grande satisfação o aguarda na próxima esquina.
Glossário
DNA: Material genético passado de pais para filhos. Ele contém as instruções para produzir os componentes celulares chamadas genes. O DNA consiste de quatro blocos de construção chamados ácidos nucleicos.
Proteínas: Os “operários” da célula – moléculas que desempenham a maioria das ações nas células e no corpo em geral. Isso inclui, por exemplo, produzir movimento (ativação muscular), transportar oxigênio e remover dióxido de carbono do sangue (respiração), construir a pele do corpo e os tecidos conectivos (estrutura) e proteger o corpo de invasores (sistema imunológico).
Aminoácidos: Blocos de construção das proteínas. Há cerca de 20 aminoácidos diferentes. Dentro das proteínas, os aminoácidos são atados uns aos outros por uma ligação peptídica. Essas ligações conectam os aminoácidos em cadeias e é assim que a proteína se forma. Uma proteína de tamanho médio consiste de 150-300 aminoácidos.
Ligação peptídica: Ligação química que une aminoácidos em uma proteína.
RNA mensageiro (RNAm): Tipo de RNA que copia a informação genética do DNA e a transmite ao ribossomo, onde serve como modelo para a síntese de proteínas. Durante o processo de síntese de proteína, o RNAm é lido pelo ribossomo e usado para montar uma cadeia de aminoácidos na ordem correta, de acordo com o código genético. A molécula de RNAm produzida por esse processo serve como uma cópia acessível e segura para ser traduzida em proteínas e se desintegra após a tradução.
Transcrição: Processo pelo qual a molécula de RNA mensageiro é criada com base na molécula de DNA. O DNA contém todas as instruções operacionais para a produção de proteínas na célula (os genes). Como o DNA é a cópia original e não pode ser substituída, a célula dispõe de vários mecanismos diferentes para protegê-la, incluindo o mecanismo de transcrição.
Ribossomo: Organela na célula que produz proteínas. O ribossomo consiste de duas subunidades, a subunidade ribossômica pequena e a subunidade ribossômica grande. Ambas são compostas de inúmeras proteínas ribossômicas e de RNA ribossômico. A subunidade ribossômica pequena é responsável por decifrar o código genético de acordo com o RNA mensageiro, enquanto a subunidade ribossômica grande é responsável pela produção de proteínas de acordo com as instruções do material genético.
Tradução: Essa é a segunda fase da síntese de proteínas, na qual a informação genética codificada no RNA mensageiro é usada para montar a cadeia de aminoácidos pelo ribossomo. À medida que os aminoácidos são adicionados à cadeia crescente, a proteína começa a avançar dentro de seu túnel em direção à saída do ribossomo e ao dobramento em sua estrutura tridimensional final.
RNA de transferência (RNAt): Cada família de moléculas de DNA exclusivas traz um aminoácido específico para o ribossomo durante a tradução. Cada RNAt é específico para uma sequência de anticódon particular que se liga a um códon complementar no RNAm e carrega o aminoácido decodificado pelo RNAm.
RNA ribossômico (RNAr): Sequência única de RNA que forma o núcleo estrutural e catalítico do ribossomo. Cerca de dois terços da massa do ribossomo são RNAr. O último terço de sua massa são proteínas ribossômicas.
Cristalografia: Técnica de pesquisa usada para determinar a estrutura tridimensional de moléculas, incluindo proteínas e ácidos nucleicos. Isso envolve o crescimento de cristais da molécula e a irradiação deles com um feixe de raio X para produzir um padrão de difração que possa ser usado para calcular as posições dos átomos nas moléculas dentro da célula unitária. Essa técnica é usada para entender as interações e funções da proteína.
Cristal: Material sólido com um padrão repetitivo de átomos ou moléculas. Esse padrão confere ao cristal propriedades especiais, como a capacidade de difratar a luz e gerar eletricidade. Os cientistas usam cristais para estudar a forma e as ligações internas das moléculas de, por exemplo, metais, compostos orgânicos, proteínas e DNA, pequenas demais para se ver no microscópico óptico.
Agradecimentos
Agradecemos a Zehava Cohen por fornecer as Figuras 1, 2 e 5.
Referências
[1] Schluenzen, F., Tocilj, A., Zarivach, R., Harms, J., Gluehmann, M., Janell, D. et al. 2000. “Structure of functionally activated small ribosomal subunit at 3.3 Ȧ resolution.” Cell 102:615–23. DOI: 10.1016/S0092-8674(00)00084-2.
[2] Zhou, X., Liao, W.-J., Liao, J.-M., Liao, P., Lu, H. 2015. “Ribosomal proteins: functions beyond the ribosome.” Mol. Cell. Biol. 7:92–104. DOI: 10.1093/jmcb/mjv014.
[3] Bashan, A., Agmon, I., Zarivach, R., Schlünzen, F., Harms, J., Berisio, R. et al. 2003. “Structural basis of the ribosomal machinery for peptide bond formation, translocation, and nascent chain progression.” Mol. Cell 11:9 –102. DOI: 10.1016/S1097-2765(03)00009-1.
[4] Schlünzen, F., Zarivach, R., Harms, J., Bashan, A., Tociji, A., Albrecht, R. et al. 2001 “Structural basis for the interaction of antibiotics with the peptidyl transferase center in eubactéria.” Nature 413:814–21. DOI: 10.1038/3510544.
Este é um artigo de acesso aberto distribuído sob os termos da Creative Commons Attribution License (CC BY). O uso, distribuição ou reprodução em outros fóruns é permitido, desde que o(s) autor(es) original(is) e o(s) proprietário(s) dos direitos autorais sejam creditados e que a publicação original nesta revista seja citada, de acordo com a prática acadêmica aceita. Não é permitido nenhum uso, distribuição ou reprodução que não esteja em conformidade com estes termos.
Encontrou alguma informação errada neste texto?
Entre em contato conosco pelo e-mail:
parajovens@unesp.br